Как составлять электронные и структурные формулы
Подобно тому как в неорганической химии основополагающей теоретической базой являются Периодический закон и Периодическая система химических элементов Д. И. Менделеева, так в органической химии ведущей научной основой служит теория строения органических соединений Бутлерова-Кекуле-Купера.
Как и любая другая научная теория, теория строения органических соединений явилась результатом обобщения богатейшего фактологического материала, который накопила органическая химия, оформившаяся как наука в начале XIX в. Открывались все новые и новые соединения углерода, количество которых лавинообразно возрастало (табл. 1).
Например, этиловый спирт и диметиловый эфир - изомеры: эти вещества имеют одинаковый состав С 2 Н 6 О, но разное строение, т. е. различный порядок соединения атомов в молекулах, а потому и разные свойства.

Уже известный вам Ф. Вёлер в одном из писем к Й. Я. Берцелиусу так описывал органическую химию: «Органическая химия может сейчас кого угодно свести с ума. Она кажется мне дремучим лесом, полным удивительных вещей, безграничной чащей, из которой нельзя выбраться, куда не осмеливаешься проникнуть...»
Большое влияние на развитие химии оказали работы английского ученого Э. Франкланда, который, опираясь на идеи атомистики, ввел понятие валентность (1853).
В молекуле водорода Н 2 образуется одна ковалентная химическая связь Н-Н, т. е. водород одновалентен. Валентность химического элемента можно выразить числом атомов водорода, которые присоединяет к себе или замещает один атом химического элемента. Например, сера в сероводороде и кислород в воде двухвалентны: H 2 S, или Н-S-Н, Н 2 O, или Н-О-Н, а азот в аммиаке трехвалентен:

В органической химии понятие «валентность» является аналогом понятия «степень окисления», с которым вы привыкли работать в курсе неорганической химии в основной школе. Однако это не одно и то же. Например, в молекуле азота N 2 степень окисления азота равна нулю, а валентность - трем:
![]()
В пероксиде водорода Н 2 O 2 степень окисления кислорода равна -1, а валентность - двум:
![]()
В ионе аммония NH + 4 степень окисления азота равна -3, а валентность - четырем:

Обычно по отношению к ионным соединениям (хлорид натрия NaCl и многие другие неорганические вещества с ионной связью) не используют термин «валентность» атомов, а рассматривают их степень окисления. Поэтому в неорганической химии, где большинство веществ имеют немолекулярное строение, предпочтительнее применять понятие «степень окисления», а в органической химии, где большинство соединений имеют молекулярное строение, как правило, используют понятие «валентность».
Теория химического строения - результат обобщения идей выдающихся ученых-органиков из трех европейских стран: немца Ф. Кекуле, англичанина А. Купера и русского А. Бутлерова.
В 1857 г. Ф. Кекуле отнес углерод к четырехвалентным элементам, а в 1858 г. он одновременно с А. Купером отметил, что атомы углерода способны соединяться друг с другом в различные цепи: линейные, разветвленные и замкнутые (циклические).
Работы Ф. Кекуле и А. Купера послужили основой для разработки научной теории, объясняющей явление изомерии, взаимосвязь состава, строения и свойств молекул органических соединений. Такую теорию создал русский ученый А. М. Бутлеров. Именно его пытливый ум «осмелился проникнуть» в «дремучий лес» органической химии и начать преобразование этой «безграничной чащи» в залитый солнечным светом регулярный парк с системой дорожек и аллей. Основные идеи этой теории впервые были высказаны А. М. Бутлеровым в 1861 г. на съезде немецких естествоиспытателей и врачей в г. Шпейере.
Кратко сформулировать основные положения и следствия теории строения органических соединений Бутлерова-Кекуле-Купера можно следующим образом.
1. Атомы в молекулах веществ соединены в определенной последовательности согласно их валентности. Углерод в органических соединениях всегда четырехвалентен, а его атомы способны соединяться друг с другом, образуя различные цепи (линейные, разветвленные и циклические).
Органические соединения можно расположить в ряды сходных по составу, строению и свойствам веществ - гомологические ряды.
- Бутлеров Александр Михайлович (1828-1886)
, Русский химик, профессор Казанского университета (1857-1868), с 1869 по 1885 г. - профессор Петербургского университета. Академик Петербургской академии наук (с 1874 г.). Создатель теории химического строения органических соединений (1861). Предсказал и изучил изомерию многих органических соединений. Синтезировал многие вещества.
Например, метан СН 4 - родоначальник гомологического ряда предельных углеводородов (алканов). Его ближайший гомолог - этан С 2 Н 6 , или СН 3 -СН 3 . Следующие два члена гомологического ряда метана - пропан С 3 Н 8 , или СН 3 -СН 2 -СН 3 , и бутан С 4 Н 10 , или СН 3 -СН 2 -СН 2 -СН 3 , и т. д.
Нетрудно заметить, что для гомологических рядов можно вывести общую формулу ряда. Так, для алканов эта общая формула С n Н 2n + 2 .
2. Свойства веществ зависят не только от их качественного и количественного состава, но и от строения их молекул.
Это положение теории строения органических соединений объясняет явление изомерии. Очевидно, что для бутана С 4 Н 10 , помимо молекулы линейного строения СН 3 -СН 2 -СН 2 -СН 3 , возможно также и разветвленное строение:

Это уже совершенно новое вещество со своими индивидуальными свойствами, отличными от свойств бутана линейного строения.
Бутан, в молекуле которого атомы расположены в виде линейной цепочки, называют нормальным бутаном (н-бутаном), а бутан, цепь атомов углерода которого разветвлена, называют изобутаном.

Существует два основных типа изомерии - структурная и пространственная.
В соответствии с принятой классификацией различают три вида структурной изомерии.
Изомерия углеродного скелета. Соединения отличаются порядком расположения углерод-углеродных связей, например рассмотренные н-бутан и изобутан. Именно этот вид изомерии характерен для алканов.
Изомерия положения кратной связи (С=С, С=С) или функциональной группы (т. е. группы атомов, определяющих принадлежность соединения к тому или иному классу органических соединений), например:

Межклассовая изомерия . Изомеры этого вида изомерии относятся к разным классам органических соединений, например рассмотренные выше этиловый спирт (класс предельных одноатомных спиртов) и диметиловый эфир (класс простых эфиров).
Различают два вида пространственной изомерии: геометрическую и оптическую.
Геометрическая изомерия характерна, прежде всего, для соединений с двойной углерод-углеродной связью, так как по месту такой связи молекула имеет плоскостное строение (рис. 6).

Рис. 6.
Модель молекулы этилена
Например, для бутена-2, если одинаковые группы атомов у атомов углерода при двойной связи находятся по одну сторону от плоскости С=С-связи, то молекула является цисизомером, если по разные стороны - трансизомером.

Оптической изомерией обладают, например, вещества, молекулы которых имеют асимметрический, или хиральный, атом углерода, связанный с четырьмя различными заместителями. Оптические изомеры являются зеркальным изображением друг друга, подобно двум ладоням, и не совместимы. (Теперь вам, очевидно, стало понятным второе название этого вида изомерии: греч. хирос - рука - образец несимметричной фигуры.) Например, в виде двух оптических изомеров существует 2-оксипропановая (молочная) кислота, содержащая один асимметрический атом углерода.

У хиральных молекул возникают изомерные пары, в которых молекулы изомеров относятся по своей пространственной организации одна к другой так же, как соотносятся между собой предмет и его зеркальное отображение. Пара таких изомеров всегда обладает одинаковыми химическими и физическими свойствами, за исключением оптической активности: если один изомер вращает плоскость поляризованного света по часовой стрелке, то другой - обязательно против. Первый изомер называют правовращающим, а второй - левовращающим.
Значение оптической изомерии в организации жизни на нашей планете очень велико, так как оптические изомеры могут существенно отличаться как по своей биологической активности, так и по совместимости с другими природными соединениями.
3. Атомы в молекулах веществ влияют друг на друга. Взаимное влияние атомов в молекулах органических соединений вы рассмотрите при дальнейшем изучении курса.
Современная теория строения органических соединений основывается не только на химическом, но и на электронном и на пространственном строении веществ, которое подробно рассматривается на профильном уровне изучения химии.
В органической химии широко используют несколько видов химических формул.
Молекулярная формула отражает качественный состав соединения, т. е. показывает число атомов каждого из химических элементов, образующих молекулу вещества. Например, молекулярная формула пропана: С 3 Н 8 .
Структурная формула отражает порядок соединения атомов в молекуле согласно валентности. Структурная формула пропана такова:

Часто нет необходимости детально изображать химические связи между атомами углерода и водорода, поэтому в большинстве случаев используют сокращенные структурные формулы. Для пропана такую формулу записывают так: СН 3 -СН 2 -СН 3 .
Строение молекул органических соединений отражают с помощью различных моделей. Наиболее известны объемные (масштабные) и шаростержневые модели (рис. 7).

Рис. 7.
Модели молекулы этана:
1 - шаростержневая; 2 - масштабная
Новые слова и понятия
- Изомерия, изомеры.
- Валентность.
- Химическое строение.
- Теория строения органических соединений.
- Гомологический ряд и гомологическая разность.
- Формулы молекулярные и структурные.
- Модели молекул: объемные (масштабные) и шаростержневые.
Вопросы и задания
- Что такое валентность? Чем она отличается от степени окисления? Приведите примеры веществ, в которых значения степени окисления и валентности атомов численно одинаковы и различны,
- Определите валентность и степень окисления атомов в веществах, формулы которых Сl 2 , СО 2 , С 2 Н 6 , С 2 Н 4 .
- Что такое изомерия; изомеры?
- Что такое гомология; гомологи?
- Как, используя знания об изомерии и гомологии, объяснить многообразие соединений углерода?
- Что понимают под химическим строением молекул органических соединений? Сформулируйте положение теории строения, которое объясняет различие в свойствах изомеров, Сформулируйте положения теории строения, которые объясняют многообразие органических соединений.
- Какой вклад внес каждый из ученых - основоположников теории химического строения - в эту теорию? Почему ведущую роль в становление этой теории сыграл вклад русского химика?
- Возможно существование трех изомеров состава С 5 Н 12 , Запишите их полные и сокращенные структурные формулы,
- По представленной в конце параграфа модели молекулы вещества (см, рис. 7) составьте его молекулярную и сокращенную структурную формулы.
- Рассчитайте массовую долю углерода в молекулах первых четырех членов гомологического ряда алканов.
2.1. Химический язык и его части
Человечество использует много разных языков.
Кроме естественных языков
(японского,
английского, русского – всего более 2,5 тысяч),
существуют еще и искусственные языки
,
например, эсперанто. Среди искусственных языков
выделяются языки
различных наук
. Так, в
химии используется свой, химический язык
.
Химический язык
– система условных
обозначений и понятий, предназначенная для
краткой, ёмкой и наглядной записи и передачи
химической информации.
Сообщение, написанное на большинстве
естественных языков, делится на предложения,
предложения – на слова, а слова – на буквы. Если
предложения, слова и буквы мы назовем частями
языка, то тогда мы сможем выделить аналогичные
части и в химическом языке (таблица 2).
Таблица 2. Части химического языка
Любым языком овладеть сразу невозможно, это относится и к химическому языку. Поэтому пока вы познакомитесь только с основами этого языка: выучите некоторые " буквы" , научитесь понимать смысл " слов" и" предложений" . В конце этой главы вы познакомитесь с названиями химических веществ – неотъемлемой частью химического языка. По мере изучения химии ваше знание химического языка будет расширяться и углубляться.
ХИМИЧЕСКИЙ ЯЗЫК.
1.Какие искусственные языки вы знаете (кроме
названных в тексте учебника)?
2.Чем естественные языки отличаются от
искусственных?
3.Как вы думаете, можно ли при описании химических
явлений обходиться без использования
химического языка? Если нет, то почему? Если да, то
в чем будут заключаться преимущества, а в чем
недостатки такого описания?
2.2. Символы химических элементов
Символ химического элемента обозначает сам
элемент или один атом этого элемента.
Каждый такой символ представляет собой
сокращенное латинское название химического
элемента, состоящее из одной или двух букв
латинского алфавита (латинский алфавит см. в
приложении 1). Символ пишется с прописной буквы.
Символы, а также русские и латинские названия
некоторых элементов, приведены в таблице 3. Там же
даны сведения о происхождении латинских
названий. Общего правила произношения символов
не существует, поэтому в таблице 3 приводится и
" чтение" символа, то есть, как этот символ
читается в химической формуле.
Заменять символом название элемента в устной
речи нельзя, а в рукописных или печатных текстах
это допускается, но не рекомендуется.В настоящее
время известно 110 химических элементов, у 109 из
них есть названия и символы, утвержденные
Международным союзом теоретической и прикладной
химии (ИЮПАК).
В таблице 3 приведена информация только о 33
элементах. Это те элементы, которые при изучении
химии вам встретятся в первую очередь. Русские
названия (в алфавитном порядке) и символы всех
элементов приведены в приложении 2.
Таблица 3. Названия и символы некоторых химических элементов
Название |
||||
Латинское |
Написание |
|||
| - | Написание |
Происхождение |
- | - |
| Азот | N itrogenium | От греч. " рождающий селитру" | " эн" | |
| Алюминий | Al uminium | От лат. " квасцы" | " алюминий" | |
| Аргон | Ar gon | От греч. " недеятельный" | " аргон" | |
| Барий | Ba rium | От греч. " тяжелый" | " барий" | |
| Бор | B orum | От арабск. " белый минерал" | " бор" | |
| Бром | Br omum | От греч. " зловонный" | " бром" | |
| Водород | H ydrogenium | От греч. " рождающий воду" | " аш" | |
| Гелий | He lium | От греч. " Солнце" | " гелий" | |
| Железо | Fe rrum | От лат. " меч" | " феррум" | |
| Золото | Au rum | От лат. " горящий" | " аурум" | |
| Йод | I odum | От греч. " фиолетовый" | " йод" | |
| Калий | K alium | От арабск. " щёлочь" | " калий" | |
| Кальций | Ca lcium | От лат. " известняк" | " кальций" | |
| Кислород | O xygenium | От греч. " рождающий кислоты" | " о" | |
| Кремний | Si licium | От лат. " кремень" | " силициум" | |
| Криптон | Kr ypton | От греч. " скрытый" | " криптон" | |
| Магний | M ag nesium | От назв. полуострова Магнезия | " магний" | |
| Марганец | M an ganum | От греч. " очищающий" | " марганец" | |
| Медь | Cu prum | От греч. назв. о. Кипр | " купрум" | |
| Натрий | Na trium | От арабск, " моющее средство" | " натрий" | |
| Неон | Ne on | От греч. " новый" | " неон" | |
| Никель | Ni ccolum | От нем. " медь святого Николая" | " никель" | |
| Ртуть | H ydrarg yrum | Лат. " жидкое серебро" | " гидраргирум" | |
| Свинец | P lumb um | От лат. названия сплава свинца с оловом. | " плюмбум" | |
| Сера | S ulfur | От санскриттского " горючий порошок" | " эс" | |
| Серебро | A rg entum | От греч. " светлый" | " аргентум" | |
| Углерод | C arboneum | От лат. " уголь" | " цэ" | |
| Фосфор | P hosphorus | От греч. " несущий свет" | " пэ" | |
| Фтор | F luorum | От лат. глагола " течь" | " фтор" | |
| Хлор | Cl orum | От греч. " зеленоватый" | " хлор" | |
| Хром | C hr omium | От греч. " краска" | " хром" | |
| Цезий | C aes ium | От лат. " небесно-голубой" | " цезий" | |
| Цинк | Z in cum | От нем. " олово" | " цинк" | |
2.3. Химические формулы
Для обозначения химических веществ используют химические формулы .
Для молекулярных веществ химическая формула
может обозначать и одну молекулу этого вещества.
Информация о веществе может быть разной, поэтому
существуют разные типы химических формул
.
В зависимости от полноты информации химические
формулы делятся на четыре основных типа: простейшие
,
молекулярные
, структурные
и пространственные
.
Подстрочные индексы в простейшейформуле не
имеют общего делителя.
Индекс " 1" в формулах не ставится.
Примеры простейших формул: вода – Н 2 О,
кислород – О, сера – S, оксид фосфора – P 2 O 5 ,
бутан – C 2 H 5 , фосфорная кислота – H 3 PO 4 ,
хлорид натрия (поваренная соль) – NaCl.
Простейшая формула воды (Н 2 О) показывает,
что в состав воды входит элемент водород
(Н) и
элемент кислород
(О), причем в любой порции
(порция – часть чего-либо, что может быть
разделено без утраты своих свойств.) воды число
атомов водорода в два раза больше числа атомов
кислорода.
Число частиц
, в том числе и число атомов
,
обозначается латинской буквой N
. Обозначив
число атомов водорода – N
H , а число
атомов кислорода – N
O , мы можем
записать, что
Или N H: N O = 2: 1.
Простейшая формула фосфорной кислоты (Н 3 РО 4) показывает, что в состав фосфорной кислоты входят атомы водорода , атомы фосфора и атомы кислорода , причем отношение чисел атомов этих элементов в любой порции фосфорной кислоты равно 3:1:4, то есть
N H: N P: N O = 3: 1: 4.

Простейшая формула может быть составлена для любого индивидуального химического вещества, а для молекулярного вещества, кроме того, может быть составлена молекулярная формула .
Примеры молекулярных формул: вода – H 2 O, кислород – O 2 , сера – S 8 , оксид фосфора – P 4 O 10 , бутан – C 4 H 10 , фосфорная кислота – H 3 PO 4 .
У немолекулярных веществ молекулярных формул нет.
Последовательность записи символов элементов в простейших и молекулярных формулах определяется правилами химического языка, с которыми вы познакомитесь по мере изучения химии. На информацию, передаваемую этими формулами, последовательность символов влияния не оказывает.
Из знаков, отражающих строение веществ, мы будем использовать пока только валентный штрих (" черточку"). Этот знак показывает наличие между атомами так называемой ковалентной связи (что это за тип связи и каковы его особенности, вы скоро узнаете).

В молекуле воды атом кислорода связан простыми
(одинарными) связями с двумя атомами водорода, а
атомы водорода между собой не связаны. Именно это
наглядно показывает структурная формула воды.
![]()
Другой пример: молекула серы S 8 . В этой молекуле 8 атомов серы образуют восьмичленный цикл, в котором каждый атом серы связан с двумя другими атомами простыми связями. Сравните структурную формулу серы с объемной моделью ее молекулы, показанной на рис. 3. Обратите внимание на то, что структурная формула серы не передает форму ее молекулы, а показывает только последовательность соединения атомов ковалентными связями.

Структурная формула фосфорной кислоты показывает, что в молекуле этого вещества один из четырех атомов кислорода связан только с атомом фосфора двойной связью, а атом фосфора, в свою очередь, связан еще с тремя атомами кислорода простыми связями. Каждый из этих трех атомов кислорода, кроме того, связан простой связью с одним из трех имеющихся в молекуле атомов водорода./p>
Сравните приведенную ниже объемную модель молекулы метана с его пространственной, структурной и молекулярной формулой:
|
|
|
В пространственной формуле метана клиновидныевалентные штрихи как бы в перспективе показывают, какой из атомов водорода находится " ближе к нам" , а какой " дальше от нас" .
Иногда в пространственной формуле указывают длины связей и значения углов между связями в молекуле, как это показано на примере молекулы воды.

Немолекулярные вещества не содержат молекул. Для удобства проведения химических расчетов в немолекулярном веществе выделяют так называемую формульную единицу .
Примеры состава формульных единиц некоторых веществ: 1) диоксид кремния (кварцевый песок, кварц) SiO 2 – формульная единица состоит из одного атома кремния и двух атомов кислорода; 2) хлорид натрия (поваренная соль) NaCl – формульная единица состоит из одного атома натрия и одного атома хлора; 3) железо Fe – формульная единица состоит из одного атома железа.Как и молекула, формульная единица – наименьшая порция вещества, сохраняющая его химические свойства.
Таблица 4
Информация, передаваемая формулами разных типов
Тип формулы |
Информация, передаваемая формулой. |
|
| Простейшая Молекулярная Структурная Пространственная |
|
|
Рассмотрим теперь на примерах, какую информацию дают нам формулы разных типов.
1. Вещество: уксусная кислота . Простейшая формула – СН 2 О, молекулярная формула – C 2 H 4 O 2 , структурная формула
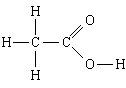
Простейшая формула
говорит нам, что
1) в состав уксусной кислоты входит углерод,
водород и кислород;
2) в этом веществе число атомов углерода
относится к числу атомов водорода и к числу
атомов кислорода, как 1:2:1, то есть N
H: N
C:N
O = 1:2:1.
Молекулярная формула
добавляет, что
3) в молекуле уксусной кислоты – 2 атома углерода,
4 атома водорода и 2 атома кислорода.
Структурная формула
добавляет, что
4, 5) в молекуле два атома углерода связаны между
собой простой связью; один из них, кроме этого,
связан с тремя атомами водорода, с каждым простой
связью, а другой – с двумя атомами кислорода, с
одним – двойной связью, а с другим – простой;
последний атом кислорода связан еще простой
связью с четвертым атомом водорода.
2. Вещество: хлорид натрия
.
Простейшая формула – NaCl.
1) В состав хлорида натрия входит натрий и хлор.
2) В этом веществе число атомов натрия равно числу
атомов хлора.
3. Вещество: железо
.
Простейшая
формула – Fe.
1) В состав этого вещества входит только железо,
то есть это простое вещество.
4. Вещество: триметафосфорная кислота . Простейшая формула – HPO 3 , молекулярная формула – H 3 P 3 O 9 , структурная формула

1) В состав триметафосфорной кислоты входит
водород, фосфор и кислород.
2) N
H: N
P:N
O = 1:1:3.
3) Молекула состоит из трех атомов водорода, трех
атомов фосфора и девяти атомов кислорода.
4, 5) Три атома фосфора и три атома кислорода,
чередуясь, образуют шестичленный цикл. Все связи
в цикле простые. Каждый атом фосфора, кроме того,
связан еще с двумя атомами кислорода, причем с
одним – двойной связью, а с другим – простой.
Каждый из трех атомов кислорода, связанных
простыми связямис атомами фосфора, связан еще
простой связью с атомом водорода.
| Фосфорная кислота – H 3 PO 4 (другое название – ортофосфорная кислота) – прозрачное бесцветное кристаллическое вещество молекулярного строения, плавящееся при 42 o С. Это вещество очень хорошо растворяется в воде и даже поглощает пары воды из воздуха (гигроскопично). Фосфорную кислоту производят в больших количествах и используют прежде всего в производстве фосфорных удобрений, а также в химической промышленности, при производстве спичек и даже в строительстве. Кроме того, фосфорная кислота применяется при изготовлении цемента в зубоврачебной технике, входит в состав многих лекарственных средств. Эта кислота достаточно дешева, поэтому в некоторых странах, например в США, очень чистая сильно разбавленная водой фосфорная кислота добавляется в освежающие напитки для замены дорогой лимонной кислоты. |
| Метан – CH 4 . Если у вас дома есть газовая плита, то с этим веществом вы сталкиваетесь ежедневно: природный газ, который горит в конфорках вашей плиты, на 95 % состоит из метана. Метан – газ без цвета и запаха с температурой кипения –161 o С. В смеси с воздухом он взрывоопасен, этим и объясняются происходящие иногда в угольных шахтах взрывы и пожары (другое название метана – рудничный газ). Третье название метана – болотный газ – связано с тем, что пузырьки именно этого газа поднимаются со дна болот, где он образуется в результате деятельности некоторых бактерий. В промышленности метан используется как топливо и сырье для производства других веществ.Метан является простейшим углеводородом . К этому классу веществ относятся также этан (C 2 H 6), пропан (C 3 H 8), этилен (C 2 H 4), ацетилен (C 2 H 2) и многие другие вещества. |
Таблица 5 . Примеры формул разных типов для некоторых веществ -
Валентность. Молекулярные формулы.
Введем еще один важный термин, нужный нам для дальнейшей работы: валентность. Число черточек, отходящих от символа элемента в структурных формулах, равно валентности этого элемента. Валентность элемента - это его способность образовывать определенное число химических связей. По числу черточек в уже знакомых нам формулах нескольких молекул видно, что водород и хлор одновалентны, кислород - двухвалентен, а азот - трехвалентен.
Валентность определяется как число электронных пар, которыми данный атом связан с другими атомами.
Поскольку в химической связи участвуют только электроны внешних оболочек, такие электроны называют валентными. Единичная (простая) ковалентная связь возникает, когда атомы делят между собой одну пару валентных электронов.
Структурные формулы наглядно показывают последовательность связывания атомов в молекуле и валентность элементов, однако если такая подробная информация не нужна, молекулы можно записывать в виде сокращенных химических формул. Например, уже знакомые нам молекулы в этом случае выглядят так:
H2
Cl2
O2
H2O
N2H4
N2H2
N2
Цифра, стоящяя внизу справа от символа элемента, называется индексом. Индекс показывает, сколько атомов данного элемента содержится в молекуле. Индекс 1 никогда не пишут. Такие формулы называют сокращенными, но чаще - молекулярными формулами, потому что они отражают состав (но не структуру!) молекул. Молекулярные формулы можно составлять по валентностям входящих в них элементов. И наоборот, зная валентности элементов, можно правильно составить из них молекулу.
** Но как определяют валентности элементов? Для этого можно воспользоваться нашими знаниями о строении внешних электронных оболочек атомов, как мы это уже делали при определении валентностей водорода, хлора, натрия, фтора, кислорода и азота в их конкретных химических соединениях.
Некоторые элементы проявляют в любых соединениях одну и ту же валентность. Таковы, например, водород, натрий, калий, серебро, фтор (валентность I); или магний, кальций (валентность II). Другие элементы могут - в зависимости от партнеров по химической реакции - проявлять несколько разных валентностей. Причину этого мы легко объясним чуть позже, исходя из строения их атомов.
В то время, когда химики еще ничего не знали о строении атомов, они успешно определили валентности многих элементов по данным химического анализа.
Анализ позволяет выяснить состав соединения, то есть численное соотношение атомов разных элементов в молекуле - молекулярную формулу. Делается это путем точного определения массы каждого элемента в образце, тщательно очищенном от примесей других веществ. С методикой анализа вы подробно познакомитесь в 10 классе. Сейчас же мы воспользуемся результатами уже проведенного анализа для определения валентности, например, азота.
Допустим, анализ чистого образца газа аммиака дает для его молекулы молекулярную формулу NH3. Можно воспользоваться тем обстоятельством, что валентность водорода всегда I (традиционно валентность обозначают римскими цифрами). Поскольку водород всегда одновалентен, его атомы в этом соединении не могут быть связаны между собой. Значит, они связаны с азотом. Вывод: валентность азота III. Для этого соединения можно придумать единственную структурную формулу:
Еще одно наблюдение: кислород во всех соединениях двухвалентен. Поэтому, например, в соединении SO2 валентность серы может быть только IV (валентность кислорода II умножить на 2 атома кислорода = 4), а в соединении SO3 валентность серы - VI (валентность кислорода II умножить на 3 атома кислорода = 6).
В более сложных случаях можно дать лишь частичный ответ, но и он бывает полезен. Например, о соединении HClO4 мы можем лишь сказать, что остаток ClO4 - одновалентен (так как мы отняли от него одновалентный атом водорода). В соединении H2SO4 остаток SO4 - двухвалентен (отняли два одновалентных атома водорода). Поэтому для определения валентности какого-либо элемента годятся только его простые соединения с водородом и кислородом, содержащие только один атом изучаемого элемента. Требование простоты весьма существенно. Например, по составу соединения СН4 (метан) можно правильно заключить, что элемент углерод четырехвалентен. Но существует и более сложное соединение углерода С6Н4 (бензол), по которому судить о валентности углерода только из результатов анализа затруднительно.
Валентности некоторых элементов (традиционно записываются римскими цифрами). Для элементов с переменной валентностью первая цифра - наиболее распространенная валентность. В скобках даны валентности, встречающиеся реже. Звездочками помечены элементы с постоянной валентностью.
Элемент
Валентность
* Водород (H)
I
* Натрий (Na)
I
* Калий (K)
I
* Серебро (Ag)
I
* Фтор (F)
I
Хлор (Cl)
I (III, V, VII)
Бром (Br)
I (III, V, VII)
Иод (I)
I (III, V, VII)
Ртуть (Hg)
I, II
Медь (Cu)
I, II
*Бериллий (Be)
II
* Магний (Mg)
II
* Кальций (Ca)
II
* Барий (Ba)
II
* Кислород (O)
II
Цинк (Zn)
II
Олово (Sn)
II (IV)
Свинец (Pb)
II (IV)
Железо (Fe)
II, III
Сера (S)
II, IV, VI
Марганец (Mn)
II, IV, VII
Хром (Cr)
III, VI
* Алюминий (Al)
III
Азот (N)
III (и другие)
Фосфор (P)
III, V
Углерод (C)
IV
Кремний (Si)
IV (II)
Мы уже знаем вполне достаточно, чтобы правильно определять валентности многих элементов по правилу октета и по электронному строению их атомов. Можно так и поступать в дальнейшем, не утруждая себя заучиванием валентностей важнейших элементов. Но на практике их проще выучить, чтобы не тратить каждый раз время на рисование электронных формул и структур Льюиса.
В таблице 3-2 приводятся сведения о валентностях элементов, с которыми мы не раз столкнемся в нашем курсе.
Теперь разберемся в том, как составляют молекулярные формулы по уже известным валентностям элементов. Нам нужно научиться делать это для сложных веществ, состоящих из двух элементов.
Например, надо записать формулу соединения железа (III) с кислородом (соединения элементов с кислородом называются оксидами). Запишем химические символы железа (Fe) и кислорода (O), а над символами поставим валентности этих элементов.Затем переместим вниз и крест-накрест значения валентностей, записав их справа (и внизу) около символов элементов в виде индексов:
Теперь сделаем проверку. Два атома 3-х валентного железа дадут в сумме (2 х III = 6) свободных валентностей и столько же свободных валентностей (3 х II = 6) обеспечат три атома II-х валентного кислорода. Свободных, неиспользованных валентностей у атомов не осталось. Значит, формула оксида железа (III) составлена правильно: Fe2O3.
Фактически, задача сводится к поиску наименьшего общего кратного для валентностей двух элементов. Поясним это на еще одном примере. Напишем формулу соединения серы (VI) с кислородом:
На первый взгляд кажется, что формула составлена правильно. На самом деле для чисел 2 и 6 имеется наименьшее общее кратное - 6, поэтому оба индекса можно сократить вдвое:
Теперь молекулярная формула оксида серы (VI) написана правильно.
3.7. В школьном курсе не изучают химию элемента скандия. Тем не менее, основываясь на электронном строении атома 21Sc, сделайте следующее:
А) напишите электронную формулу скандия и определите его наиболее вероятную валентность (пользуясь правилом октета);
Б) напишите формулу Льюиса для соединения скандия с хлором;
В) напишите молекулярную и структурную формулы соединения скандия с хлором;
Г) определите: будет ли связь Sc-Cl ковалентной (один вариант), либо (второй вариант) - полярной ковалентной или ионной.
3.8. 1) Используя валентности элементов, напишите молекулярные формулы соединений: а) калия с фтором; б) магния с кислородом; в) кальция с водородом; г) алюминия с фтором; д) алюминия с кислородом.
2) Нарисуйте структурные формулы соединений и определите валентность каждого атома: а) HCl; б) BeCl2; в) AlBr3; г) PH3; д) TiCl4.
** 3.9. Напишите одну молекулярную формулу и нарисуйте по крайней мере две теоретически возможные структурные формулы соединения хрома (III) с кислородом. Подсказка: одна из этих структур содержит кратные связи, другая - циклическая.
3.10. Напишите формулы Льюиса для соединений: H2S, CO2, BeO, I2, ICl. Найдите здесь соединение с ковалентной связью.
** 3.11. Напишите электронную формулу валентной оболочки элемента 34Se. Сколько поделенных и сколько неподеленных электронных пар в соединении H2Se? Нарисуйте его структурную формулу.
** 3.12. Напишите формулу Льюиса и нарисуйте структурную формулу для соединения SF6. Сколько поделенных и сколько неподеленных электронных пар в этом соединении? Примечание: фтор – сильнейший акцептор электронов, поэтому электронные пары химических связей сдвинуты от атома серы к атомам фтора. Какому инертному газу “подражает” сера в этом соединении – аргону или неону?
3.13. Наш старый знакомый Юх нарисовал свой химический автопортрет, повесил его в лаборатории и сказал, что со временем обязательно синтезирует такое соединение. Оно обязательно будет обладать какими-нибудь необычными свойствами. Доктор Пилюлькин сразу нашел ошибку в портрете и сказал Юху, что такое соединение вряд ли можно синтезировать. Какую ошибку смог найти доктор Пилюлькин?
В следующий параграф.
_________________



